Rahmenbedingungen
Nach der Einführung der Medical Device Regulation (MDR) im Mai 2021, ist ab Ende Mai 2022 die In-vitro-Diagnostica-Regulation (IVDR) verpflichtend anzuwenden. Für Herstellende von pH-Papieren zur Bestimmung des pH-Wertes im Urin, über Schwangerschaftstest bis hin zu Software für die Gesundheitsdiagnose, bedeutet dies einen drastischen Einschnitt. Die IVDR wie auch die MDR haben sich zum Ziel gesetzt, die Sicherheit für Patienten zu verbessern und zu gewährleisten – absolut richtig und wichtig – aber dahinter steckt ein neuer enormer bürokratischer Aufwand für Hersteller*innen und auch der Umsetzungs-Prozess ist noch mit vielen Unsicherheiten behaftet.
Der Workshop
Hier setzte der Workshop an und versuchte das Thema IVDR von allen Seiten zu beleuchten und für die Teilnehmenden die verschiedenen Aspekte transparent zu machen. Dazu gab Dr. Sebastian Grömminger vom Johner-Institut einen Gesamtüberblick zum Gesetz, über den aktuellen Stand von der Einführung eines Produkts bis hin zur Marktüberwachung (Post Market Surveillance). Dr. Philip Wien (DIHK) stellte die Ergebnisse verschiedener Umfragen der IHK´s in Deutschland vor, beleuchtete die Herausforderungen aus Sicht der Hersteller*innen und zeigte, wo und wie DIHK und weitere Organisationen sich, im Sinne der Produzenten, für eine leichtere Umsetzung der gesetzlichen Anforderungen stark machen.
Ein wichtiger Aspekt aus Sicht der Herstellenden ist, dass Großbritannien und die Schweiz von den Verfahren der EU abweichen. Hier sind weitere Aspekte zu beachten, wenn ein Hersteller in diesen Ländern weiterhin aktiv sein will. Im Zuge dessen beschrieb Dr. Ludger Möller von der MDSS GmbH sehr klar die Herausforderungen, aber auch Lösungsansätze, wie Unternehmen mit durchaus moderatem Aufwand weiter in diesen Märkten tätig sein können.
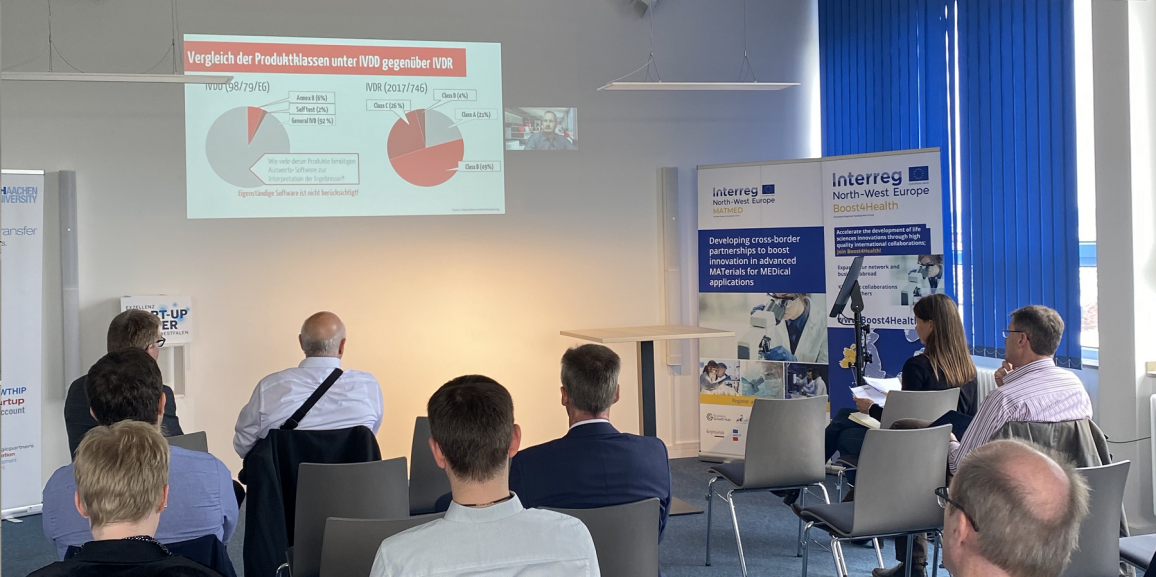
Unabhängig von den Märkten EU, Großbritannien oder Schweiz liegt zunächst der Ball bei den Herstellenden und der Deadline am 26. Mai 2022. Bis dahin müssen Produzenten von IVDR-Produkten ihre Produkte zunächst selbst den Risikoklassen der IVDR zuordnen, damit anschließend die jeweilige Kennzeichnung bzw. Zertifizierung gemäß dieser Klasse erfolgen kann. Dazu erläuterte Dr. Philipp Hohenbrink (MDSS GmbH) die Klassifizierungsregeln der IVDR im Detail und arbeitete die Bedeutung der Zweckbestimmung heraus. Je nach Produkt besteht hier durch eine klare eindeutige Definition des Zwecks, der Schlüssel zu einem effizienten Zertifizierungsprozess.
Zwei wesentliche Aspekte der IVDR sind einerseits die Breite der Produkte, die unter die Regularien fallen und das völlig neue Produkte nun in den Bereich der Medizinprodukte einzuordnen sind. Hier konnten die Teilnehmenden von zwei Industrievorträgen lernen. Dr. Markus Meusel von Macherey und Nagel aus Düren schilderte die Herausforderungen, den Aufwand und die Überlegungen eines Diagnostika-Herstellers mit einer sehr breiten Palette von Produkten. Er zeigte die verschiedenen Blickwinkel, aber auch Entscheidungen und Kosten für ein mittelständisches Unternehmen auf. Neben diesen typischen Herausforderungen eines etablierten Unternehmens, präsentierte Dr. Martin Neumann von der infoteam Software AG die Sicht eines Softwareentwicklers und verdeutlichte, wie vielfältig die Anforderungen schon bei wenig komplex erscheinenden Produkten werden können.
Die Teilnehmenden erhielten einen aktuellen und informativen Gesamtüberblick. Vor allem Start-Ups und junge Unternehmen konnten erkennen, welche Herausforderungen sie erwarten und erste Ansätze mitnehmen, diese erfolgreich umzusetzen.
Die Organisatoren, RWTH Innovation GmbH, RegionAachen, ClusterMedizin.NRW, und der MedLife e.V.danken den Referenten*innen für die sehr gelungenen Beiträge. Als Ausblick für alle 38 Teilnehmenden vor Ort und online: Es wird ein Herbstworkshop organisiert, der über Zulassungsstrategien für MedTech-Produkte informieren wird. Weitere Informationen dazu demnächst auf dieser Webseite oder über LinkedIn.